INTRODUÇÃO
Este blog descreve a física e os conceitos por trás da linha de sensores de oxigênio dinâmicos e altamente precisos da PST e explica como eles podem ser usados para medir a umidade.
Ao ler este blog, tenha em mente os seguintes diferenciais importantes entre a linha de sensores da PST e outros sensores de oxigênio de dióxido de zircônio:
FÍSICA DE FUNDO
1.1 Pressão parcial
1.1.1 Definição
A pressão parcial é definida como a pressão de um único componente de gás em uma mistura de gases. Ela corresponde à pressão total que o componente de gás único exerceria se ocupasse sozinho todo o volume.
1.1.2 Lei de Dalton
A pressão total (Ptotal) de uma mistura de gases ideais é igual à soma das pressões parciais (Pi) dos gases individuais nessa mistura.
| k |
| i=1 |
Da Equação 1, pode-se deduzir que a razão entre o número de partículas (ni) de um componente individual do gás e o número total de partículas (ntotal) da mistura de gases é igual à razão entre a pressão parcial (Pi) do componente individual do gás e a pressão total (Ptotal) da mistura de gases.
| ni |
| ntotal |
| Pi |
| Ptotal |
| ni | Número de partículas no gás |
| ntotal | Número total de partículas |
| pi | Pressão parcial do gás i |
| Ptotal | Pressão total |
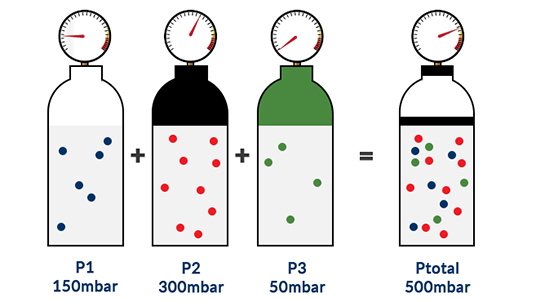
Exemplo 1:
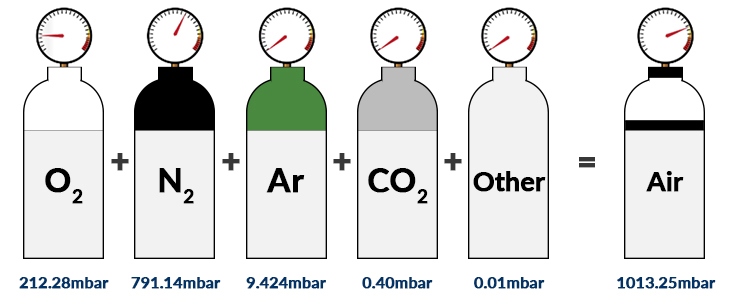
A pressão atmosférica no nível do mar (sob condições atmosféricas padrão) é de 1013,25mbar. Aqui, os principais componentes do ar seco são nitrogênio (78,08% Vol.), oxigênio (20,95% Vol.), argônio (0,93% Vol.) e dióxido de carbono (0,04% Vol.). O conteúdo volumétrico (%) pode ser igualado ao número de partículas (n), pois os gases acima podem ser aproximados como gases ideais.
A Equação 2 pode ser resolvida para a pressão parcial de um gás individual (i) para obter:
| ni |
| ntotal |
A pressão parcial de oxigênio equivale então a:
| 20. 95% |
| 100% |
É claro que esse valor só é relevante quando a atmosfera está seca (0% de umidade). Se houver umidade, uma proporção da pressão total é absorvida pela pressão do vapor de água. Portanto, a pressão parcial de oxigênio (ppO2) pode ser calculada com mais precisão quando a umidade relativa e a temperatura ambiente são medidas juntamente com a pressão barométrica total.

Primeiro, a pressão de vapor da água é calculada:
| HRel |
| 100 |
| WVP | Pressão de vapor da água (mbar) |
| HRel | Umidade relativa (%) |
| WVPmax | Pressão máxima de vapor de água (mbar), que depende da temperatura |
Para uma temperatura de gás conhecida, a pressão máxima de vapor de água (WVPmax) pode ser determinada a partir da tabela de pesquisa no APÊNDICE A. A pressão máxima de vapor de água também é chamada de ponto de orvalho. O ar mais quente pode reter mais vapor de água e, portanto, tem uma pressão de vapor de água (WVPmax) mais alta do que o ar mais frio.
A pressão parcial de oxigênio equivale a:
| 20. 95 |
| 100 |
| ppO2 | Pressão parcial de O2 (mbar) |
| (Ptotal) | Pressão total (mbar), que é o mesmo que pressão barométrica quando estamos falando de ar ambiente. |
| WVP | Pressão de vapor de água (mbar) |
O Exemplo 2 abaixo descreve o efeito da umidade reduzindo a pressão parcial de oxigênio e, portanto, o conteúdo volumétrico de oxigênio.
Exemplo 2:
Em um dia típico, as seguintes informações são registradas em uma estação meteorológica calibrada:
| Temperatura | 22°C |
| Umidade | 32% |
| Pressão barométrica Ptotal | 986mbar |
Usando a tabela de pesquisa no APÊNDICE A, WVPmax = 26,43mbar.
| 32 |
| 100 |
A pressão parcial de oxigênio, então, equivale a:
| 20. 95 |
| 100 |
Como agora sabemos a pressão parcial de oxigênio e a pressão barométrica total, podemos calcular o conteúdo volumétrico de oxigênio.
| 204. 8 |
| 986 |
Medição da umidade no ar
Vimos que os sensores de oxigênio PST medem um componente, ppO2, de uma mistura de gases. Se também soubermos o Ptotal, poderemos calcular a porcentagem de oxigênio na mistura. Para uma mistura de gases conhecida, como o ar, se detectarmos uma redução na concentração de oxigênio, isso só pode ocorrer porque algum outro gás foi introduzido e diluiu os gases contidos no ar.
Dessa forma, a umidade do gás pode ser inferida, e podemos usar o sensor de oxigênio como um sensor de umidade. A vantagem de usar os sensores de oxigênio da PST para medir a umidade, em comparação com outros sensores que medem diretamente a umidade, é a capacidade de medir em alta temperatura. Os sensores de umidade baseados em capacitância, por exemplo, geralmente são limitados à operação em baixas temperaturas (<100oC). Os sensores de oxigênio da PST são capazes de operar em temperaturas de gás de até 400 oC.
Ao reorganizar as equações acima, podemos mostrar que:
| 100 |
| WVPmax |
| 100 | |
| 20. 95 |
Desde que saibamos que o gás em questão é o ar e que a única coisa que foi adicionada é água, então a equação 7 é válida. Portanto, esse método pode ser usado para medir a umidade em aplicações como cozimento a vapor, assamento e secagem.
Esse método de medição de umidade é simples, porque a mistura de gases que chamamos de "ar" é abundante, difundida e consistente, onde quer que estejamos no planeta.
A tabela de pesquisa no APÊNDICE A está limitada a temperaturas de até 130oC. Para fazer cálculos acima desse valor, outras tabelas ou equações devem ser usadas.
Medição da umidade em outros gases
Quando o gás não é o ar, o cálculo da umidade a partir do oxigênio torna-se mais complexo. A redução da pressão do oxigênio indica que os constituintes do gás foram alterados, mas talvez não saibamos por que ou como. Veja, por exemplo, o processo de combustão. Em vez da diluição simples e proporcional do ar (O2, N2, CO2, Ar etc.) pela introdução de H2O, em um processo de combustão o H2O é produzido junto com o CO2, enquanto o O2 e os hidrocarbonetos (CxHy) que foram queimados são reduzidos.
Somente com a medição dos outros gases residuais, incluindo o O2, é possível calcular a umidade.
APÊNDICE A - TABELA DE TABELA DE PROCURA DE PRESSÃO DE VAPOR DE ÁGUA
Tabela de consulta para a pressão máxima de vapor de água.
| Temperatura (°C) | Pressão máxima de vapor de água pressão (mbar) | Temperatura (°C) | Pressão máxima de vapor de água de água (mbar) |
| 0 | 6,1 | 31 | 44,92 |
| 1 | 6,57 | 32 | 47,54 |
| 2 | 7,06 | 33 | 50,3 |
| 3 | 7,58 | 34 | 53,19 |
| 4 | 8,13 | 35 | 56,23 |
| 5 | 8,72 | 36 | 59,42 |
| 6 | 9,35 | 37 | 62,76 |
| 7 | 10,01 | 38 | 66,27 |
| 8 | 10,72 | 39 | 69,93 |
| 9 | 11,47 | 40 | 73,77 |
| 10 | 12,27 | 42,5 | 84,19 |
| 11 | 13,12 | 45 | 95,85 |
| 12 | 14,02 | 47,5 | 108,86 |
| 13 | 14,97 | 50 | 123,86 |
| 14 | 15,98 | 52,5 | 139,5 |
| 15 | 17,04 | 55 | 457,42 |
| 16 | 18,17 | 57,5 | 177,25 |
| 17 | 19,37 | 60 | 199,17 |
| 18 | 20,63 | 62,5 | 223,36 |
| 19 | 21,96 | 65 | 250,01 |
| 20 | 23,37 | 67,5 | 279,31 |
| 21 | 24,86 | 70 | 311,48 |
| 22 | 26,43 | 75 | 385,21 |
| 23 | 28,11 | 80 | 473,3 |
| 24 | 29,82 | 85 | 577,69 |
| 25 | 31,66 | 90 | 700,73 |
| 26 | 33,6 | 95 | 844,98 |
| 27 | 35,64 | 100 | 1013,17 |
| 28 | 37,78 | 110 | 1433,61 |
| 29 | 40,04 | 120 | 1988,84 |
| 30 | 42,42 | 130 | 2709,58 |
APÊNDICE B - NOTAS ESPECIAIS E DICAS DE APLICAÇÃO
Para garantir o melhor desempenho do seu equipamento, é importante que o sensor de oxigênio conectado seja instalado e mantido corretamente.
O documento Zirconia Sensor Operation and Compatibility Guide fornece algumas dicas essenciais de operação do sensor e uma lista completa de gases e materiais que DEVEM ser evitados para garantir uma longa vida útil do sensor ou agende uma chamada com nossos especialistas técnicos em oxygen@processsensing.com.
Produtos relacionados
Sensor de oxigênio de dióxido de zircônio parafusado
Sensor de oxigénio em zircónio miniatura
Sonda Sensor de oxigênio de dióxido de zircônio
Quer ver mais informações como esta?
Inscreva-se em um de nossos boletins informativos do setor e receba nossas notícias e insights relacionados mais recentes diretamente em sua caixa de entrada!
Sign Up